¿Cuáles son ejemplos de moléculas polares y no polares?
SoluciónEl agua es polar. … El metanol es polar. … El cianuro de hidrógeno es polar. … El oxígeno es no polar. … El propano es no polar, porque es simétrico, conH átomos unidos a cada lado alrededor de los átomos centrales y sin pares de electrones no compartidos.
¿Cuáles son ejemplos de moléculas polares y no polares?
Ejemplos de moléculas polares son HCl,H2O,NH3 , y de moléculas no polares son H2,O2,Cl2.
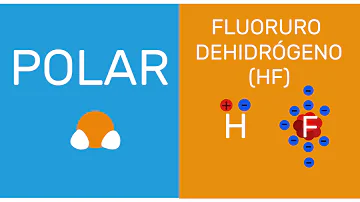
¿Qué son las moleculas no polares ejemplos?
Algunos ejemplos de moléculas covalentes no polares son: hidrógeno molecular, oxígeno molecular, nitrógeno molecular, metano (CH4), propano (C3H8) y butano (C4H10).
¿Cuáles son los ejemplos de moléculas polares?
El agua (H2O) es polar, el amoníaco (NH3) es polar, el dióxido de azufre (SO2) es polar, el sulfuro de hidrógeno (H2S) es polar.
¿Cómo se llaman las moleculas no polares?
Una molécula es polar cuando uno de sus extremos está cargado positivamente, y el otro de manera negativa. Cuando una molécula es apolar, estas cargas no existen.
¿Cuáles son las moleculas polares y apolares?
Las moléculas con enlaces polares en la que la distribución de átomos no es simétrica, son POLARES. Por otro lado, aquellas moléculas que están enlazadas a átomos idénticos, distribuidos simétricamente, son APOLARES.
¿Cómo se sabe si es polar o no polar?
Las moléculas con enlaces polares en la que la distribución de átomos no es simétrica, son POLARES. Por otro lado, aquellas moléculas que están enlazadas a átomos idénticos, distribuidos simétricamente, son APOLARES.
¿Cómo saber si es polar o no polar?
( Si la diferencia de electronegatividad de los átomos en un enlace es superior a 0,4, consideramos que el enlace es polar . Si la diferencia de electronegatividad es inferior a 0,4, el enlace es esencialmente no polar). Si no hay enlaces polares, la molécula es no polar
¿Cuáles son los no polares?
Las moléculas no polares son aquellas moléculas que se producen por la unión entre átomos que poseen igual electronegatividad, por lo que las fuerzas con las que los átomos que conforman la molécula atraen los electrones del enlace son iguales, produciéndose así la anulación de dichas fuerzas.
¿Qué moléculas son apolares?
En la práctica,las moléculas apolares pueden ser: Moléculas covalentes formadas por átomos iguales. Ejemplos: hidrógeno (H2); oxígeno (O2); nitrógeno (N2); azufre (S8). Moléculas covalentes formadas por átomos de parecida electronegatividad.
¿Qué son los no polares?
Las moléculas no polares son aquellas moléculas que se producen por la unión entre átomos que poseen igual electronegatividad, por lo que las fuerzas con las que los átomos que conforman la molécula atraen los electrones del enlace son iguales, produciéndose así la anulación de dichas fuerzas.
¿Cuáles son los compuestos no polares?
Sustancias No Polares
Una molécula no polar tiene la distribución de electrones uniforme y no tiene regiones del precio positivo o negativo.
¿Qué productos químicos de la lista no son polares?
Los solventes no polares incluyen alcanos (pentano, hexano y heptano) y aromáticos (benceno, tolueno y xileno) . Otros solventes no polares comunes incluyen ácido acético, cloroformo, éter dietílico, acetato de etilo, cloruro de metileno y piridina.
¿Cómo sé si es polar o apolar?
Cuando se trata de un enlace covalente polar, los electrones se comparten desigualmente, lo que significa que hay separación de cargas. En los enlaces covalentes apolares, la distribución de cargas es homogénea.
¿Cómo se sabe si es polar O no polar?
Las moléculas con enlaces polares en la que la distribución de átomos no es simétrica, son POLARES. Por otro lado, aquellas moléculas que están enlazadas a átomos idénticos, distribuidos simétricamente, son APOLARES.
¿Cuál es la diferencia entre moléculas polares y no polares?
Las moléculas polares tienen una distribución uniforme de densidad electrónica. Una molécula no polar resulta de una distribución desigual de la densidad de electrones . Los compuestos polares están dispuestos asimétricamente. Tienen enlaces polares que son simétricos.
¿Cómo saber si un enlace es polar o no polar?
Aunque no existen reglas estrictas y rápidas, la regla general es que si la diferencia de electronegatividades es inferior a 0,4, el enlace se considera no polar ; si la diferencia es superior a 0,4, el enlace se considera polar.
¿Cuáles son los enlaces no polares?
Covalente puro o no polar: Los electrones del enlace se comparten por igual entre los dos núcleos de los átomos enlazados. Lo presentan moléculas biatómicas homonucleares (H2, N2, Cl2, …). Covalente polar: Los electrones del enlace no se comparten por igual entre los dos núcleos.
¿Cómo saber si una molécula es polar o no polar?
Pasos para identificar moléculas polares
- Dibuja la estructura de Lewis.
- Determinar la geometría (usando la teoría VSEPR)
- Visualizar o dibujar la geometría.
- Encuentra el momento dipolo neto (no tienes que hacer cálculos si puedes visualizarlo)
- Si el momento dipolo neto es cero, es no polar. De lo contrario, es polar.
